
Cara Menentukan Bilangan Oksidasi dan Contohnya
Senyawa CuSO4.5H2O merupakan senyawa hidrat, sehingga untuk menentukan biloksnya kita dapat memisahkan bagian hidrat dan senyawa utamanya, yaitu CuSO4 dan H2O. Bilangan oksidasi unsur-unsur pada senyawa CuSO4.5H2O, adalah: - biloks O = -2 - biloks H = +1 CuSO4 → Cu2+ + SO42- biloks S + 4 (biloks O) = -2 biloks S + 4 (-2) = -2 biloks S = -2.
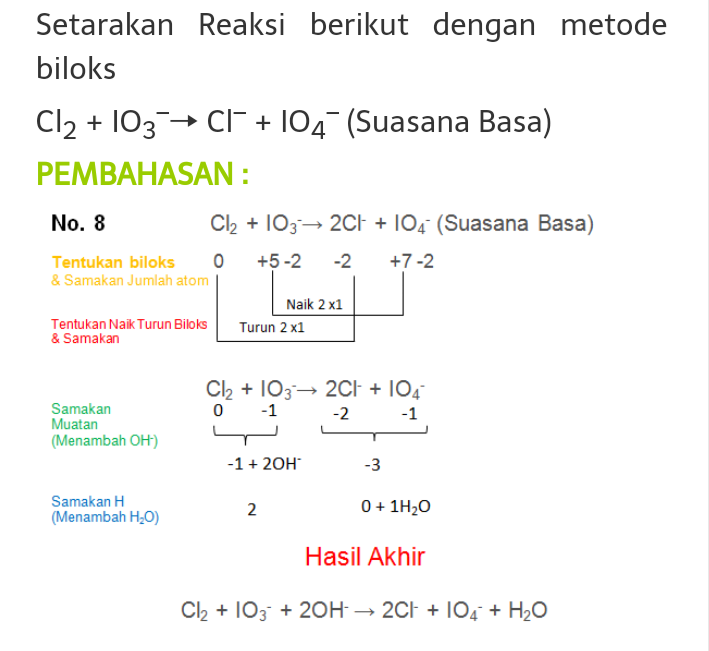
Contoh Soal Penyetaraan Reaksi Redoks Metode Bilangan Oksidasi Suasana Asam Riset
1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya. 5.
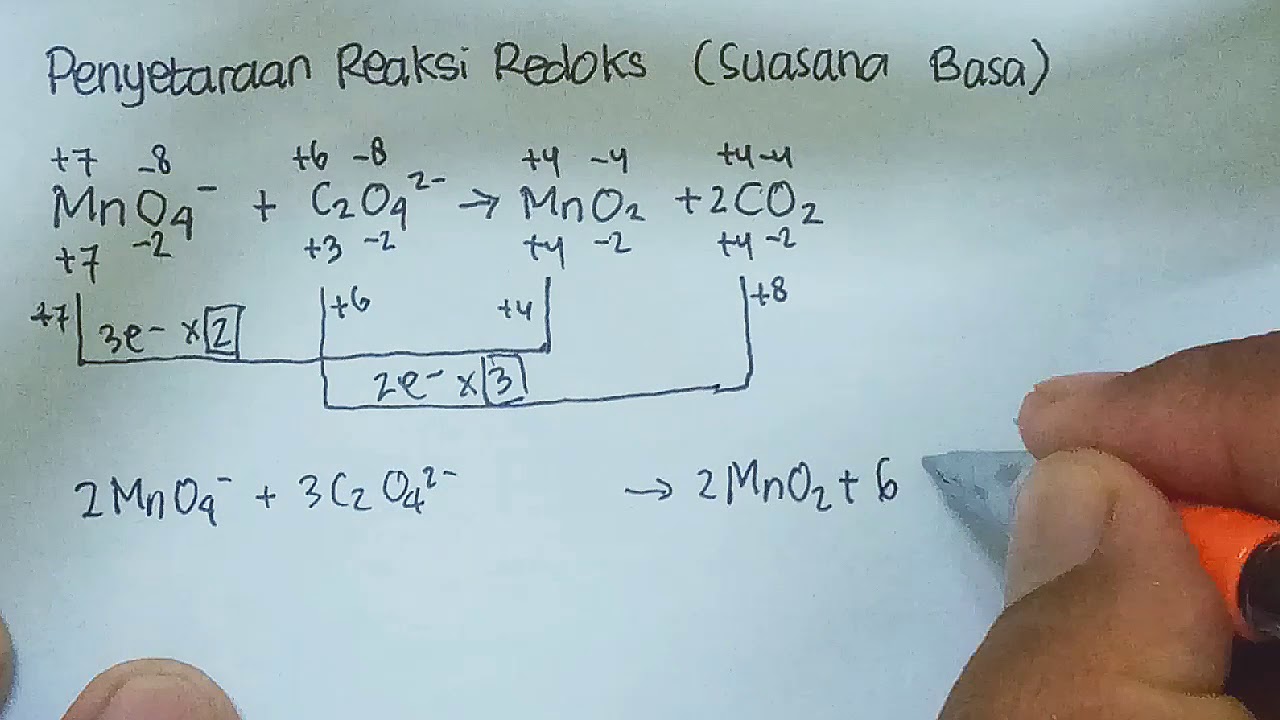
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
Cara Menentukan Bilangan Oksidasi Dari Unsur Yang Terdapat Di Dalam Senyawa Ion Poliatomik. S dalam CuSO4 = Senyawa CuSO4 ini memiliki 2 unsur non prioritas yaitu unsur Cu dan unsur S dan juga senyawa CuSO4 ini memiliki 1 unsur prioritas yaitu unsur O , maka untuk mencari biloks dari unsur S , kita gunakan rumus formula 2X, tetapi sebelum.

PENENTUAN BILANGAN OKSIDASI (BILOKS). YouTube
Dalam kimia, bilangan oksidasi, biloks, atau keadaan oksidasi, adalah muatan hipotesis sebuah atom jika semua ikatannya dengan atom yang berbeda sepenuhnya ionik.Bilangan ini menggambarkan tingkat oksidasi (kehilangan elektron) dari sebuah atom dalam senyawa kimia.Secara konseptual, bilangan oksidasi dapat berupa bilangan positif, negatif, atau nol. Walaupun ikatan ionik sepenuhnya tidak.

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Bilangan oksidasi (biloks) suatu unsur adalah bilangan bulat yang digunakan untuk memudahkan perhitungan perpindahan elektron dari satu atom, molekul, atau ion ke atom, molekul atau ion. H2SO4 4 N, larutan sampel, Fe(NO3)2 0,1 M, ZnSO4 0,1 M, CuSO4 0,1 M, Pb(NO3) 0,1 M, dan HCl 4 M. 3.3 Skema Kerja 3.3.1 Titrasi redoks KMnO4 dimasukkan ke.

Cara Menentukan Bilangan Oksidasi Matob
Jawaban terverifikasi. Halo Ana, kakak bantu jawab pertanyaanmu yaa Bilangan oksidasi total CuSO₄ adalah 0, dengan biloks Cu = +2, biloks O = -2, dan biloks S = +6. Yuk simak penjelasan berikut, agar kamu lebih paham yaa ^^ Bilangan oksidasi (biasa disingkat menjadi biloks) adalah jumlah muatan positif dan negatif suatu atom.

Aturan Penentuan Bilangan Oksidasi Materi Reaksi Redoks Kimia SMA Pojan.id YouTube
Bilangan Oksidasi Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation state.
.png)
Reaksi Redoks Pengertian, Ciri, Konsep, dan Menentukan BIlangan Oksidasi
Reaksi Reduksi dan Oksidasi serta Tata Nama Senyawa; Bilangan Oksidasi Unsur dalam Senyawa atau Ion; Tentukan bilangan oksidasi masing-masing atom dalam senyawa atau ion berikut! 1. CuSO4 2. K2Cr2O2 3. MnO4 4. KIO3 5. ClO^-Bilangan Oksidasi Unsur dalam Senyawa atau Ion; Reaksi Reduksi dan Oksidasi serta Tata Nama Senyawa; Kimia Fisik dan Analisis

Cara Menentukan Bilangan Oksidasi Dunia Sosial
tentang bilangan oksidasi, telah dibahas dalam topik sebelumnya. Reaksi redoks mencakup reaksi reduksi dan oksidasi. Reaksi reduksi adalah reaksi yang terjadi penurunan bilangan oksidasi melalui penangkapan elektron, contohnya : Cu2+ (aq) + 2e → Cu (s) Sedangkan reaksi oksidasi adalah reaksi yang terjadi peningkatan bilangan oksidasi melalui.

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Halo Amanda, kaka bantu jawab ya :) Jawabanya: zat yang bertindak sebagai oksidator adalah CuSO4. Berdasarkan perubahan bilangan oksidasinya, reaksi redoks adalah reaksi yang mengalami kenaikan bilangan oksidasi (reaksi oksidasi) dan reaksi yang mengalami penurunan bilangan oksidasi (reaksi reduksi).

Menghitung Bilangan Oksidasi Unsur
Reaksi reduksi adalah reaksi yang terjadi penurunan bilangan oksidasi melalui penangkapan elekton.. Sedangkan reaksi oksidasi adalah reaksi pelepasan elektron atau reaksi kenaikan bilangan oksidasi. Pada percobaan I larutan CuSO4 yang warnanya biru muda dimasukkan ke tabung reaksi. Kemudian ditambahkan logam Zn yang berwarna abu. Setelah itu.

Kumpulan Soal Dan Pembahasan Bilangan Oksidasi
Bilangan oksidasi unsur O pada H 2 O, KOH, H 2 SO 4 dan Na 3 PO 4 ialah -2. 7. Jumlah suatu bilangan oksidasi unsur-unsur dalam senyawa ialah 0 (nol). ' Jumlah pada bilangan oksidasi unsur-unsur pembentuk ion poliatom adalah sama dengan muatan ion poliatomnya tersebut. Contoh Soal Bilangan Oksidasi. 1.
Cara Menentukan Bilangan Oksidasi Matob
Untuk mencari nilai biloks tidak perlu menyetarakan reaksi karena koefisiennya tidak berpengaruh. 2CuSO4 +4KI → 2K2SO4 +2CuI+ I2 +2 +1. Berdasarkan data tersebut dapat disimpulkan bahwa Cu mengalami penurunan biloks dari +2 menjadi +1, sehingga CuSO4 mengalami reduksi dan hasil reduksinya adalah CuI.

Bilangan Oksidasi Dan Tatanama
4. Tetapkan bilangan oksidasi -2 pada oksigen (tanpa perkecualian). Dalam hampir semua kasus, atom oksigen memiliki bilangan oksidasi -2. Ada beberapa perkecualian dalam peraturan ini: Saat oksigen berada dalam bentuk unsur (O 2 ), bilangan oksidasinya adalah 0, karena ini adalah peraturan untuk semua atom unsur.

Cara menentukan Biloks ( Bilangan Oksidasi ) Reaksi Redoks YouTube
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Pada elektrolisis larutan CuSO4 seperti terlihat pada gam...
Cu pada CuSO4 mengalami reduksi yaitu perubahan bilangan oksidasi dari +2 menjadi 0. Sehingga, Zn dapat dikatakan sebagai reduktor yaitu mereduksi Cu tetapi Zn sendiri mengalami oksidasi. Cu dapat dikatakan sebagai oksidator yaitu mengoksidasi unsur lain tetapi Cu sendiri mengalami reduksi.