
Bilangan Oksidasi Cl Dalam Senyawa Naclo3 cara pasang bondek yang benar
Pada ion OH-, bilangan oksidasi O ditambah dengan bilangan oksidasi H = -1. Pada ion SO42-, bilangan oksidasi S ditambah dengan 4 kali bilangan oksidasi O = -2. Pada ion NH+4, bilangan oksidasi N ditambah dengan 4 kali bilangan oksidasi H = +1. 5. Bilangan oksidasi unsur-unsur golongan alkali (IA) dalam berbagai senyawa yang dibentuknya adalah +1

Bilangan Oksidasi Tertinggi Dari Atom Ci Terdapat Pada Senyawa Lengkap
3. Bilangan oksidasi atom Cr yang sama dengan bilangan oksidasi atom Mn yang terdapat pada senyawa MnO₂ adalah 4. Bilangan oksidasi Ba pada bilangan Ba₂0₂ adalah 5. Bilangan oksidasi dari H₂O adalah 6. Bilangan oksidasi dari Ag₂O adalah 7. Bilangan oksidasi dari Mn³⁺ adalah 8. Bilangan oksidasi dari H₂SO₄ 9.

Cara Menentukan Bilangan Oksidasi dan Contohnya
Beberapa aturan penentuan biloks unsur dalam senyawa adalah sebagai berikut, Jumlah biloks unsur dalam senyawa netral = 0 Biloks unsur logam golongan IIA dalam senyawa = +2 Biloks H dalam senyawa hidrida nonlogam = +1 Biloks O dalam senyawa biasanya = -2 Biloks unsur halogen (F, Cl, Br, I) dalam senyawa biasanya = -1 Berdasarkan aturan tersebut.

Cara Menentukan Bilangan Oksidasi Matob
Untuk menentukan bilangan oksidasi dari suatu unsur dalam senyawa, terdapat aturan - aturan yang harus dipenuhi, yaitu sebagai berikut.. Cu, H 2, Cl 2, dan N 2 memiliki bilangan oksidasi 0. Secara umum unsur H memiliki bilangan oksidasi +1, kecuali dalam senyawa hidrida -1. Contoh bilangan oksidasi H pada H 2 O, NH 3, dan HBr adalah +1.

Bilangan Oksidasi S Yang Terkecil Terdapat Dalam Lengkap
Ion memiliki bilangan oksidasi yang sama dengan muatannya. Hal ini berlaku untuk ion-ion yang tidak terikat dengan unsur-unsur lain, maupun ion-ion yang merupakan bagian dari senyawa ionik. Misalnya, ion Cl-memiliki bilangan oksidasi -1. Ion Cl masih memiliki bilangan oksidasi -1 saat Cl merupakan bagian dari senyawa NaCl. Karena ion Na, secara.

g
3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) Contoh: Senyawa NaCl; Pada senyawa NaCl, jumlah bilangan oksidasi Na dan Cl harus sama dengan nol. Adapun bilangan oksidasi Na dalam NaCl adalah +1, sedangkan bilangan oksidasi Cl dalam NaCl adalah -1 sehingga jumlah kedua bilangan oksidasi.

Cara Menentukan Bilangan Oksidasi Unsur Dalam Senyawa Kelas 10 YouTube
Biloks Mn = +6. A. Biloks Cr pada CrO (senyawa netral, maka total biloksnya = 0) total biloks = biloks Cr + biloks O. 0 = biloks Cr + (-2) Biloks S = +2 (salah, karena tidak sama dengan 6) B. Biloks Cr pada (senyawa netral, maka total biloksnya = 0) Atom Cr dan Cl memiliki lebih dari satu biloks, maka kita harus lakukan ionisasi terlebih dahulu.

Bilangan oksidasi cl dalam senyawa kclo2 adalah Sinhala
18. Jelaskan yang dimaksud senyawa anorganik! Jawaban: Senyawa anorganik merupakan senyawa yang disusun oleh atom utama logam, banyak kita jumpai pada zat yang tidak hidup, misalnya tanah, batu-batuan, air laut, dan lainnya. 19. Sebutkan klasifikasi dari materi!

Bilangan Oksidasi Cl Dalam Senyawa Naclo3 cara pasang bondek yang benar
Atom H pada AlH 3 berindeks 3, jadi biloks H = -3 dibagi 3 (indeks H) = -1. Jadi terbukti jika bilangan oksidasi H bertemu logam (Al) adalah -1. 8. Bilangan Oksidasi Oksigen (O) adalah -1 dalam Senyawa Peroksida dan -2 dalam Senyama Non-Peroksida. Contoh dari penerapan aturan ini seperti misalnya pada H 2 O 2 (hidrogen peroksida) bilangan.
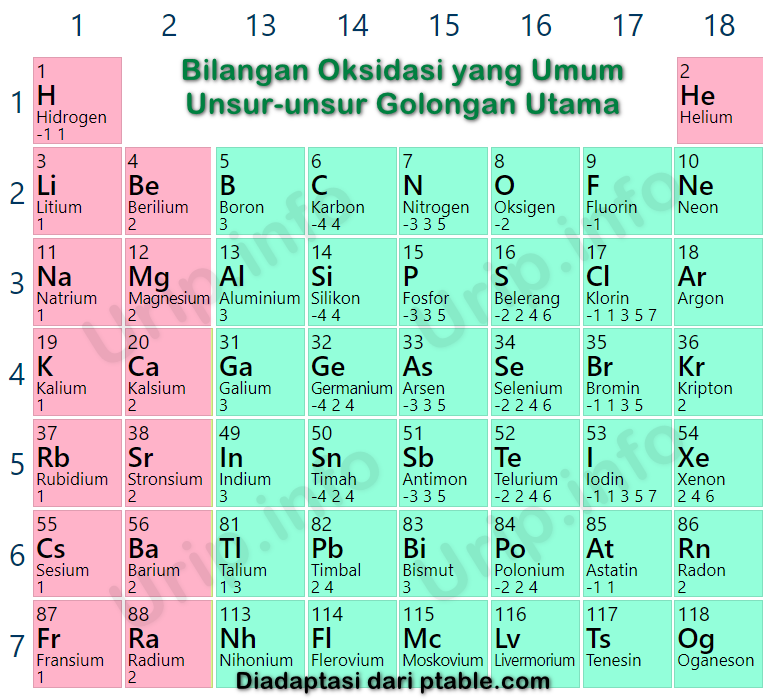
Mengapa Cl Mempunyai Bermacammacam Bilangan Oksidasi? Urip dot Info
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Bilangan Oksidasi Tertinggi Unsur O Terdapat Dalam Senyawa Blog Yuri
Bilangan oksidasi (biloks) atau keadaan oksidasi didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Tanda (+) dan (-) pada biloks ditulis sebelum angkanya, misalnya +2, atau +1; sedangkan.

Bilangan oksidasi Mn tertinggi terdapat pada senyawa....
Jika terdapat Soal Ujian yang seperti itu, jika kalian telah memahami dan mengetahui Peraturan Bilangan Oksidasi didalam Kimia maka sudah tentu kalian bisa mengerjakan Soal tersebut dengan mudah dan benar.. Yang Keenam adalah Jumlah Bilangan Oksidasi pada Senyawa Netral yang sama dengan 0 (Nol). Sebagai contohnya jika kalian melihat Senyawa.

Bilangan Oksidasi Cl Terkecil Terdapat Dalam Senyawa Lengkap
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Atom memiliki bilangan oksidasi lebih dari satu. Apabila berikatan dengan atom yang jauh lebih kecil ke-elektronegatif-an-nya akan mempunyai biloks negatif, sebaliknya apabila berikatan dengan atom yang keelektronegatifan-nya lebih besar akan mempunyai biloks positif.. Biloks dalam . Biloks adalah 0. Ca merupakan logam golongan IIA sehingga biloksnya adalah +2.

Bilangan Oksidasi Tertinggi Dari Atom Ci Terdapat Pada Senyawa Lengkap
Bilangan oksidasi unsur H pada NaH, CaH 2, dan AlH 3 ialah -1. 6. Bilangan oksidasi unsur O pada senyawanya ialah -2, kecuali :', yaitu: 1. Pada senyawa biner dengan F, bilangan oksidasinya ialah +2. 2. Pada senyawa peroksida, seperti H 2 O 2, Na 2 O 2 dan BaO 2 , bilangan oksidasinya ialah -1. 3. Pada senyawa superoksida, seperti KO 2 dan.

Cara Menentukan Bilangan Oksidasi Dunia Sosial
Biloks dari ion seperti hidrida adalah sama dengan muatan ion, dalam hal ini adalah -1.' Bilangan oksidasi unsur H pada H 2 O, HCl, H 2 S, dan NH 3 adalah +1. Bilangan oksidasi unsur H pada NaH, CaH 2, dan AlH 3 adalah -1. 6. Bilangan oksidasi unsur O pada senyawanya adalah -2, kecuali :' 1. Pada senyawa biner dengan F, bilangan oksidasinya.