Penurunan Tekanan Uap, Ini Pengertian dan Rumusnya!
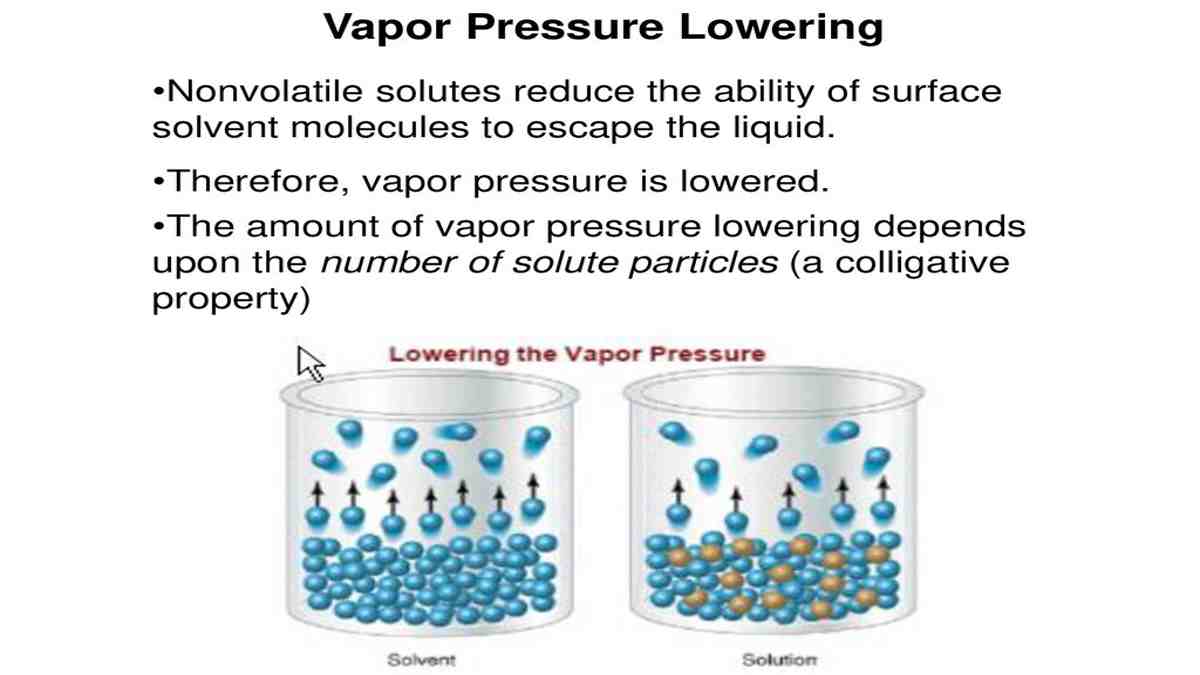
Faktor-faktor yang mempengaruhi tekanan uap menurut hukum Raoult. Pada tahun 1880-an F.M.Raoult, menyatakan bahwa besarnya tekanan uap larutan bergantung pada jumlah partikel zat terlarut di dalam larutan. Penurunan tekanan uap jenuh tidak bergantung pada jenis zat yang dilarutkan. Penurunan tekanan uap larutan adalah selisih antara tekanan uap pelarut murni dan tekanan uap larutan yang dirumuskan

Penurunan Tekanan Uap Larutan Download
Destilasi adalah sebuah aplikasi yang mengikuti prinsip-prinsip "Jika suatu zat dalam larutan tidak sama-sama menguap, maka uap larutan akan mempunyai komponen yang berbeda dengan larutanaslinya". Jika salah satu zat menguap dan yang lain tidak, pemisahan dapat terjadi sempurna.
Contoh Soal Penurunan Tekanan Uap Homecare24
Besarnya penurunan tekanan uap jenuh larutan sebanding (berbanding lurus) dengan fraksi mol zat terlarut (yaitu jumlah zat terlarut) dan suhu. Salah satu sifat koligatif adalah penurunan tekanan uap jenuh larutan. Tekanan uap jenuh adalah tekanan yang ditimbulkan oleh uap jenuh. Tekanan uap jenuh tergantung dari jenis zat dan suhunya.

Sifat Koligatif Larutan Part 1 Penurunan Tekanan Uap dan Kenaikan Titik Didih YouTube
Penurunan tekanan uap adalah sifat koligatif larutan yang disebabkan penambahan zat terlarut ke dalam suatu pelarut untuk membentuk larutan. Baca juga: Sifat Koligatif Larutan Non-Elektrolit Dilansir dari Chemistry LibreTexts , tekanan uap adalah tekanan kesetimbangan dari pelarut ketika laju penguapan sama dengan laju kondensasinya.

Penurunan tekanan uap suatu larutan yang terdiri atas cam...
Pembahasan. Cara menjawab soal ini sebagai berikut: ΔP = P o - P. P = 23,76 mmHg - 22,84 mmHg = 0,92 mmHg. Jadi penurunan tekanan uap larutan sebesar 0,92 mmHg. Contoh soal 2. Hitunglah tekanan uap larutan 2 mol glukosa dalam 50 mol air pada suhu 300 °C jika tekanan uap air murni pada 300 °C adalah 31,80 mmHg. Pembahasan.

Video Penurunan Tekanan Uap Larutan YouTube
Besarnya penurunan tekanan uap jenuh larutan sebanding dengan selisih dari tekanan uap jenuh pelarut murni $\mbox{P}^{\circ}$ dengan tekanan uap larutan (P).. Berapakah penurunan tekanan uap jenuh larutan untuk larutan berikut jika diketahui tekanan uap jenuh air adalah 31,82 mmHg : a. 6 gram urea $\mbox{(CO(NH}_{2}\mbox{)}_{2}).

PENURUNAN TEKANAN UAP DAN KENAIKAN TITIK DIDIH YouTube
Tekanan uap adalah tekanan yang ditimbulkan oleh uap yang secara termodinamika setimbang dengan fase kondensasi pada temperatur tertentu.. › Tekanan Uap Larutan. Tekanan Uap Larutan November 30, 2014 January 22, 2017 Ilmu Kimia Kimia Fisika, Sifat-sifat Larutan tekanan uap. Pengertian.

penurunan tekanan uap, sifat koligatif, UN kimia 2016 pembahasan 027 YouTube
Contoh Soal Penurunan Tekanan Uap Larutan. 1. Tekanan uap air pada suhu 25 0C adalah 23,76 mmHg. Jika pada suhu yang sama, kedalam 900 mL air ditambahkan urea (Mr = 60 g/mol), tekanan uap larutan menjadi 22,84 mmHg. Penurunan tekanan uap larutan tersebut adalah… Diketahui: T = 25 0C. P0 = 23,76 mmHg. V = 900 mL. Mr = 60 g/mol. P = 22,84 mmHg.

Download Contoh Soal Penurunan Tekanan Uap Background
Sebab uapnya sedikit, maka tekanan uap jenuhnya pun lebih kecil. Selisih antara tekanan uap pelarut murni dengan tekanan uap pelarut dalam larutan lah yang disebut sebagai penurunan tekanan uap jenuh larutan (∆P). Besarnya penurunan tekanan uap jenuh larutan ini pun diselidiki oleh Raoult dengan rumus sebagai berikut: ΔP = Xt x Pᵒ

SOLUTION 2 penurunan tekanan uap larutan Studypool
Dari tabel diatas terlihat bahwa besarnya tekanan uap sebanding dengan kenaikan suhunya. Semakin tinggi suhunya maka semakinn besar tekanan uap dari sebuah larutan.. Untuk lebih paham mari kita kerjakan 1 contoh soal sifat koligatif larutan (penurunan tekanan uap) berikut. Contoh Soal. Jika tekanan uap air pada suhu 26o C adalah 25,51 mmHg.
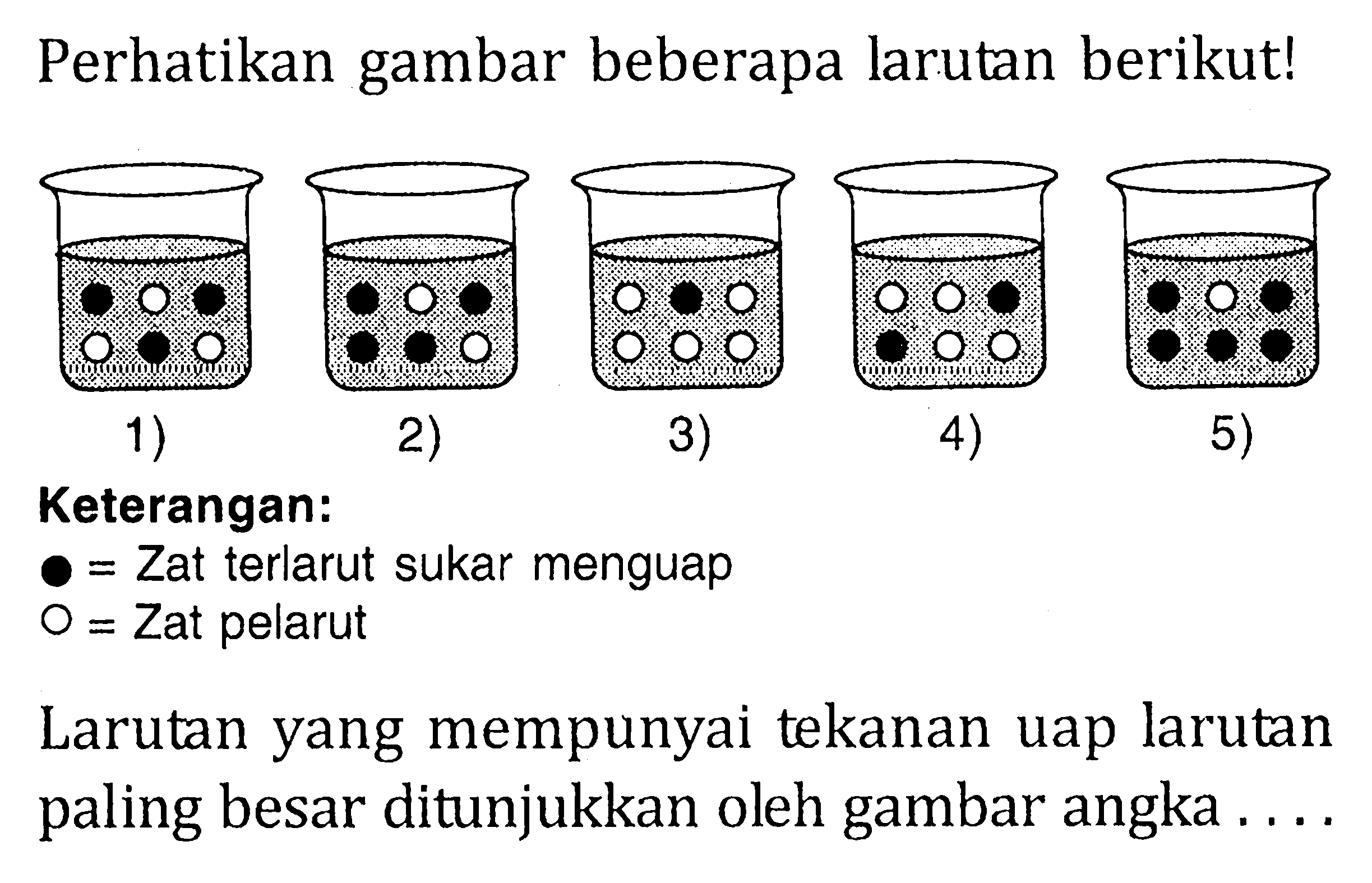
Penurunan tekanan uap larutan disebabkan oleh
Besarnya penurunan tekanan uap larutan merupakan selisih dari tekanan uap pelarut murni dengan tekanan uap larutan. Penurunan tekanan uap larutan ini berbanding lurus dengan fraksi mol zat terlarut. Dengan demikian, semakin besar nilai fraksi mol zat terlarut, maka semakin rendah tekanan uap larutan. Rumus penurunan tekanan uap adalah: Δ P.

Animasi Sifat Koligatif Larutan Penurunan Tekanan Uap Free download cek deksripsi YouTube
Hukum Raoult Hukum Raoult adalah hukum yang dicetuskan untuk mempelajari sifat-sifat tekanan uap larutan yang mengandung zat pelarut yang bersifat nonvolatil, serta membahas mengenai aktivitas air. Francois M. Raoult, pencetus Hukum Raoult Hukum Raoult tentang Campuran Ideal Bunyi dari hukum Raoult adalah: "tekanan uap larutan ideal dipengaruhi oleh tekanan uap pelarut dan fraksi mol zat.

Penurunan Tekanan Uap Larutan Pembahasan Soal YouTube
Teman-teman kelas 12, kita belajar tentang tekanan uap dan penurunan tekanan uap, yuk! Simak penjelasan dan lihat contoh soalnya, ya!. Larutan yang memiliki tekanan uap paling tinggi adalah larutan dengan penurunan tekanan uap paling kecil. Oleh karena itu, nilai fraksi mol pun zat terlarut juga harus yang paling kecil. Larutan 1 hanya.

SIFAT KOLIGATIF LARUTAN PENURUNAN TEKANAN UAP YouTube
Kejadian itu akibat dari adanya proses penguapan dan penurunan tekanan uap. Untuk memahami fenomenanya, lebih baik kamu simak terlebih dahulu pengertian tekanan uap pada pelarut murni. Selain itu juga pelajari besarnya tekanan uap yang dipengaruhi oleh penambahan zat terlarut ke dalam pelarut murni. Simak terus! 1. Tekanan uap Pelarut Murni (Po.
Besarnya Penurunan Tekanan Uap Larutan
Pembahasan. Semua sifat koligatif larutan termasuk penurunan tekanan uap dipengaruhi jumlah partikel zat terlarut. Jumlah partikel zat terlarut ini dapat dinyatakan dengan konsentrasi seperti molaritas, molalitas, dan fraksi mol. Rumus penurunan tekanan uap adalah sebagai berikut. Jadi, besarnya penurunan tekanan uap akan sebanding dengan.

Sifat koligatif larutan kelas 12 Penurunan Tekanan Uap YouTube
Jawaban: X pelarut = 1 - x etanol = 1 - 0,25 = 0,75. P = X pelarut . P 0. P = 0,75 . 80 = 60 mmHg. ∆P = P 0 - P = 80 - 60 = 20 mmHg. Sedangkan untuk tekanan uap larutan elektrolit dipengaruhi oleh fraksi mol dan faktor Van't Hoff (i). Faktor Van't Hoff (i) adalah nilai yang mempengaruhi konsentrasi larutan pada perhitungan sifat.