
Mudah😆 !! Pasangan AsamBasa menurut Teori Bronsted Lowry YouTube
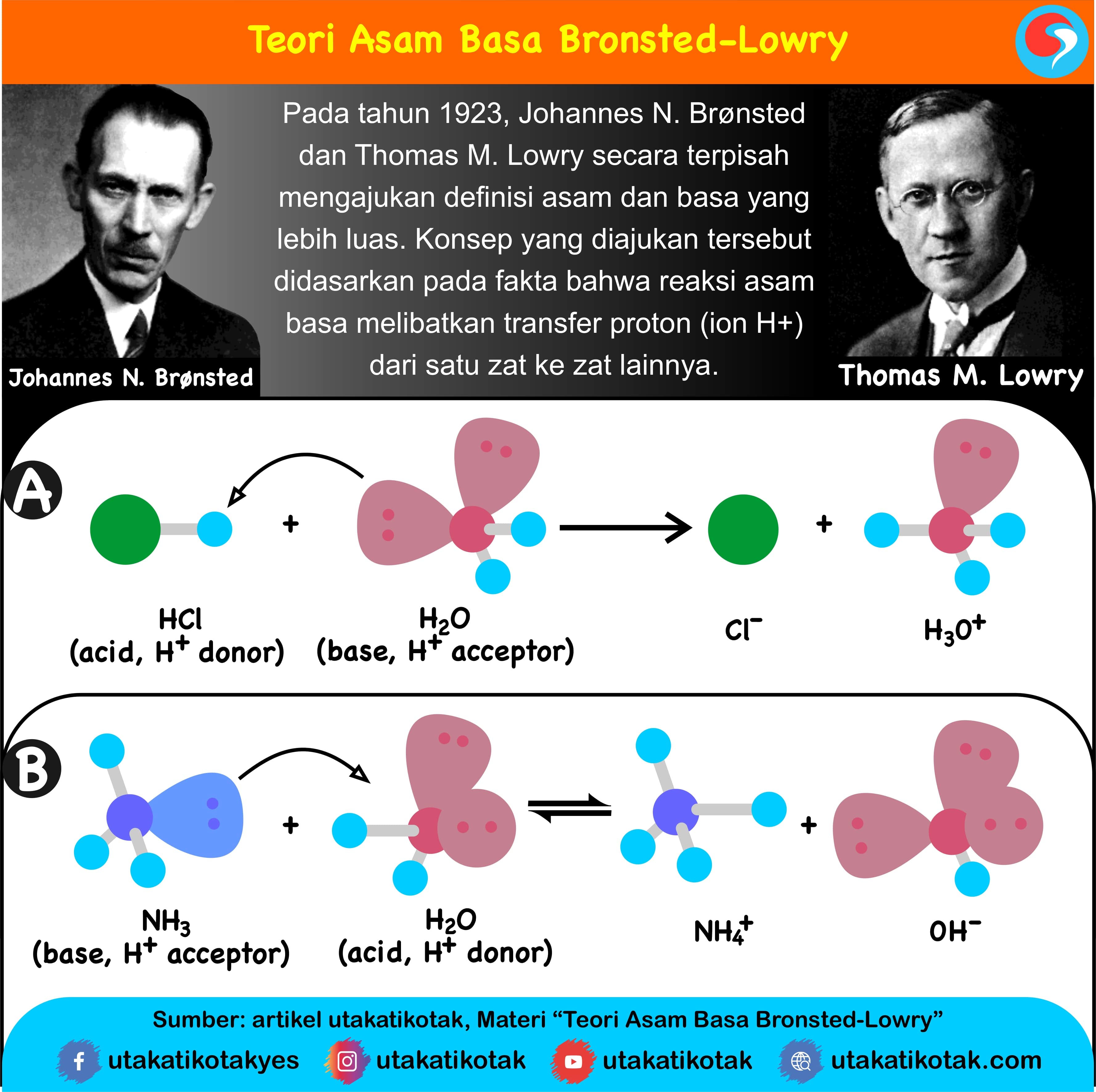
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

Kimia Sma Asam Basa Bronsted Lowry Menentukan Asam Atau Basa Suatu Sexiz Pix
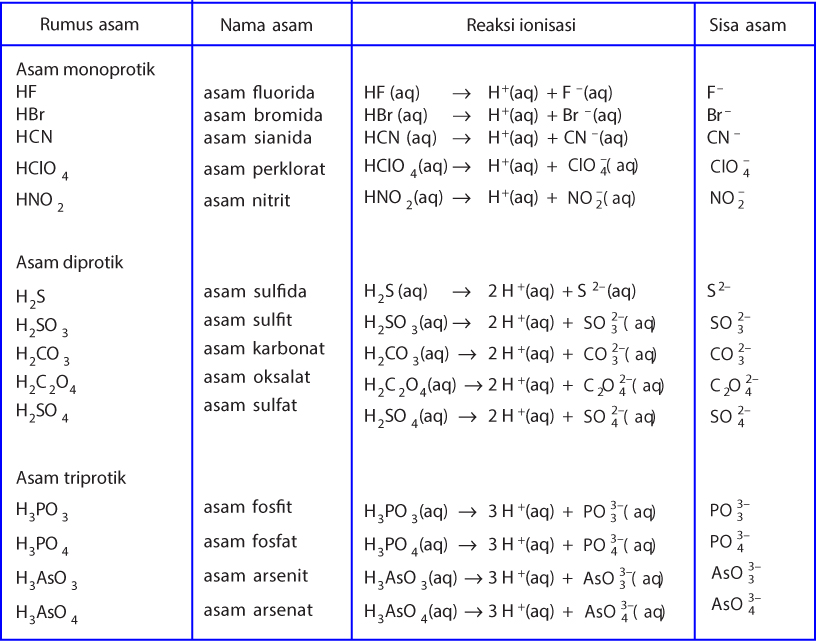
Pengertian basa menurut teori asam basa bronsted-lowry adalah zat atau spesi (ion/molekul) yang menjadi penerima proton (akseptor H+ atau penerima hidrogen). Teori Bronsted-Lowry bisa digunakan saat menjelaskan sifat dari asam basa dengan menggunakan berbagai macam pelarut, tidak hanya air (H2O). Jadi bisa dituliskan bahwa: Asam = donor H+ Basa.
Teori Asam dan Basa Menurut BronstedLowry
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Teori Asam Basa Bronsted-Lowry dikemukakan oleh Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923. Teori ini dapat menjawab kekurangan yang terdapat pada teori Arhennius. Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Teori Bronsted-Lowry Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H+). Menurut konsep Bronsted dan Lowry: Asam adalah zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat.
Menurut Konsep Asam Basa Bronsted Lowry mari semua dansa denganku lirik
Teori Asam Basa Menurut Ahli. Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya. Teori Asam Basa Arrhenius. Svante Arrhenius adalah seorang ilmuwan asal Swedia yang telah berhasil mengemukakan teori asam dan basa pada tahun.

Teori Asam Basa Arrheniuss, BronstedLowry,
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
50. Rangkuman 1 Teori Asam-Basa Bronsted-Lowry. Rangkuman 2 Teori Asam-Basa Bronsted-Lowry. Rangkuman 3 Teori Asam-Basa Bronsted-Lowry. Kuis Akhir Teori Asam-Basa Bronsted-Lowry. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
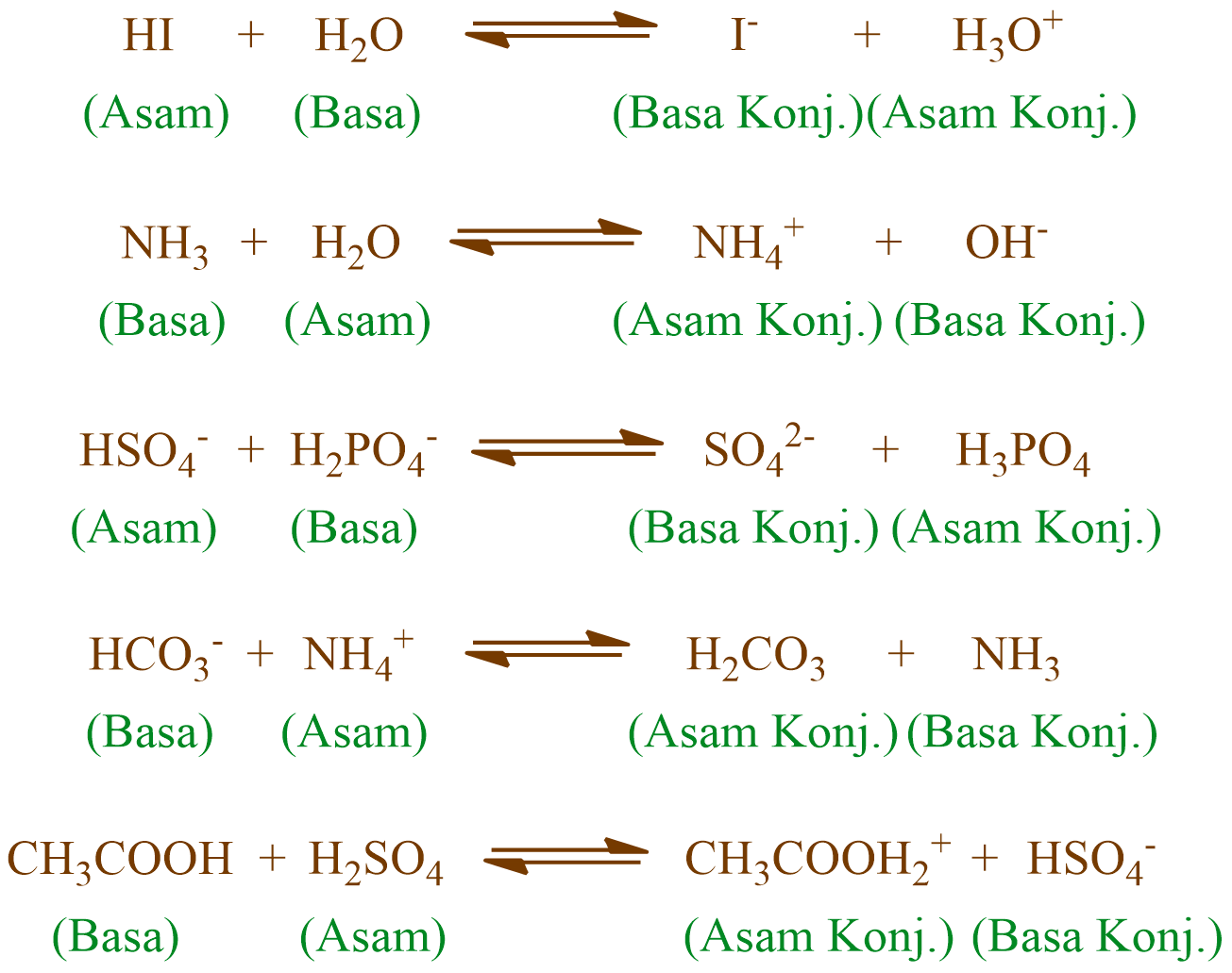
Jadi, menurut definisi asam basa Brønsted-Lowry, asam adalah donor proton. basa adalah akseptor proton. Jika ditinjau dengan teori Brønsted-Lowry, pada reaksi ionisasi HCl ketika dilarutkan dalam air, HCl berperan sebagai asam dan H 2 O sebagai basa. HCl(aq) + H 2 O(l) → Cl − (aq) + H 3 O + (aq)

Teori Asam Basa Bronsted Lowry YouTube
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Menurut Lewis, asam merupakan akseptor pasangan elektron dan basa merupakan pendonor pasangan elektron. Teori ini juga diklaim memiliki kelebihan dalam mengidentifikasi reaksi asam-basa yang berada dalam benda padat, gas, dan medium pelarut lain (bukan air biasa), serta tidak melibatkan transfer proton (teori Bronsted-Lowry).
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Contoh Mengidentifikasi Asam dan Basa Bronsted Lowry. Tidak seperti asam dan basa Arrehenius, pasangan asam basa Bronsted Lowry bisa terbentuk tanpa adanya reaksi di dalam larutan berair. Sebagai contoh, amonia dan juga hidrogen klorida bisa bereaksi membentuk amonium klorida padat menurut beberapa reaksi seperti berikut: NH3(g) + HCl(g) →.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Konsep asam-basa menurut Bronsted-Lowry adalah konsep yang lebih luas daripada konsep Arrhenius. Menurut konsep Bronsted-Lowry, asam adalah zat yang dapat melepaskan proton (H+) dan basa adalah zat yang dapat menerima proton (H+). Konsep ini digunakan untuk menjelaskan sifat asam-basa dalam larutan non-air, seperti dalam larutan amonia atau.