
g
Tetapkan bilangan oksidasi -2 pada oksigen (tanpa perkecualian). Dalam hampir semua kasus, atom oksigen memiliki bilangan oksidasi -2. Ada beberapa perkecualian dalam peraturan ini: Saat oksigen berada dalam bentuk unsur (O 2 ), bilangan oksidasinya adalah 0, karena ini adalah peraturan untuk semua atom unsur.

Contoh Soal Reduksi Oksidasi
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Bilangan Oksidasi Atom Mn YouTube
Bilangan oksidasi atom dalam unsur bebas netral sama dengan nol. Contohnya, biloks Fe, Li, Na, O2, dan P4 sama dengan nol.. Bilangan oksidasi ion poliatomik sama dengan muatan keseluruhan ion, misalnya biloks NH4+ adalah +1 dan biloks SO4 2- adalah -2. Bilangan oksidasi oksigen dalam senyawa peroksida adalah -1 dan dalam enyawa non peroksida.
Cara Menentukan Bilangan Oksidasi dan Contohnya
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Jumlah atom oksigen dalam senyawa kapur Ca(OH)2 adalah
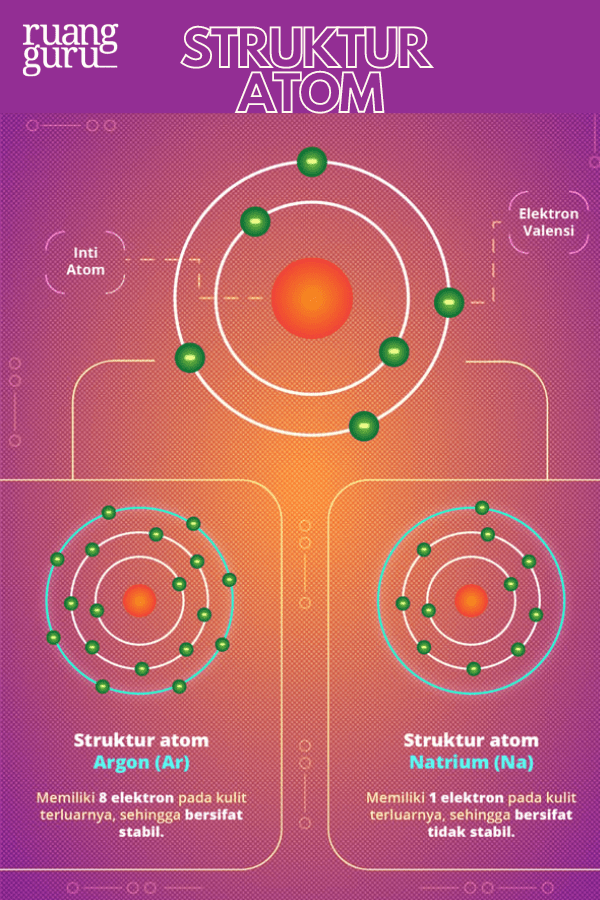
Pengertian Bilangan Oksidasi (Biloks) Bilangan oksidasi (biloks) adalah bilangan positif atau negatif yang menunjuk pada muatan suatu spesies bila elektron-elektron dianggap terdistribusi pada atom-atom menurut aturan tertentu. Aturan distribusi ini adalah secara ionik bagi spesies heteronuklir yang artinya terjadi perpindahan elektron kepada.

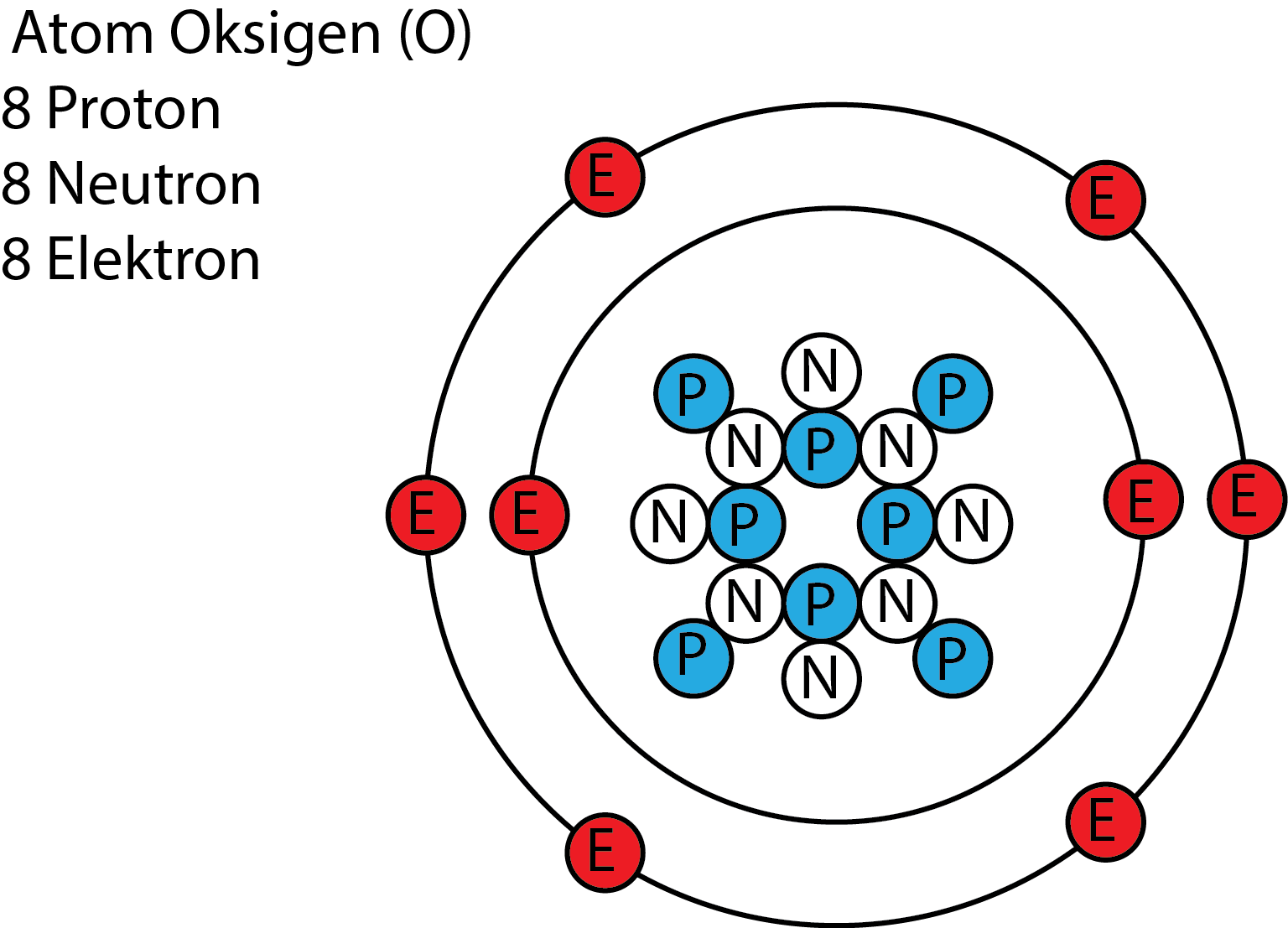
Struktur Atom Oksigen MateriKimia
- Oksidator adalah sumber oksigen pada reaksi oksidasi atau zat yang mengalami reduksi. c. Penjelasan. 2. Bilangan oksidasi ion monoatom (1 atom) dan poliatom (lebih dari 1 atom) sesuai dengan jenis muatan ionnya. Contohnya adalah sebagai berikut. a. Bilangan oksidasi ion monoatom Na+, Mg2+, dan Al3+ berturut-turut adalah +1, +2, dan +3.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.

Pada reaksi 2CO+2NO > 2CO2+N2 Bilangan oksidasi C beru...
Sifat atom; Bilangan oksidasi: −2, −1, 0, +1, +2: Elektronegativitas: Skala Pauling: 3,44 :. Keadaan oksidasi oksigen adalah -2 untuk hampir semua senyawa oksigen yang diketahui. Keadaan oksidasi -1 ditemukan pada beberapa senyawa seperti peroksida. Senyawa oksigen dengan keadaan oksidasi lainnya sangat jarang ditemukan, yakni -1/2.

Peristiwa Pelepasan Oksigen Disebut Dengan….
Bedakan dengan bilangan oksidasi. Dalam kimia, keadaan oksidasi merupakan indikator derajat oksidasi sebuah atom dalam suatu senyawa kimia.Keadaan oksidasi formal merupakan muatan hipotetis yang suatu atom peroleh apabila semua ikatan yang berikatan dengan atom tersebut adalah sepenuhnya bersifat ionik.Keadaan oksidasi berupa bilangan bulat, ia dapat berupa nilai positif, negatif, ataupun nol.

Elektron Valensi Oksigen Studyhelp
1. Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Nilai Bilangan Oksidasi Dari S Didalam Na2so 3 Adalah peristiwa yang terjadi pada fabel
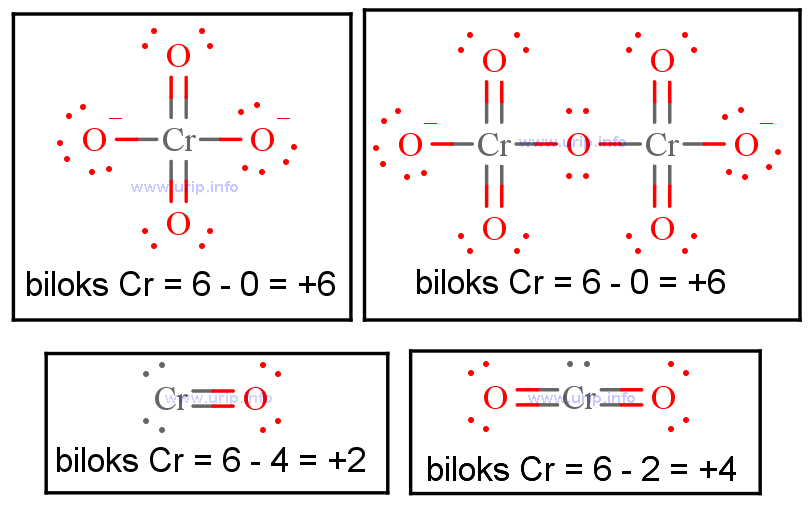
S O 2 SO_2 Tentukan bilangan oksidasi sulfur S S dan oksigen O O . Bilangan oksidasi sulfur adalah +4, dan oksigen -2. Nama senyawa ini menjadi "sulfur dioxide." Contoh Soal Redoks. Tentukan apakah reaksi berikut merupakan reaksi oksidasi, reduksi, atau reaksi redoks. Tuliskan bilangan oksidasi dari setiap unsur yang.
Molekul Unsur dan Senyawa Kimia Kenal Sains
Unsur bebas dengan bentuk atom, sebagai contoh: Cu, K, Ca, C, Nae, Fe, Al, Na;. Jadi terbukti jika bilangan oksidasi H bertemu logam (Al) adalah -1. 8. Bilangan Oksidasi Oksigen (O) adalah -1 dalam Senyawa Peroksida dan -2 dalam Senyama Non-Peroksida. Contoh dari penerapan aturan ini seperti misalnya pada H 2 O 2 (hidrogen peroksida.
Catatan tentang Bilangan Oksidasi Serba Ada
Oksidasi adalah salah satu reaksi kimia yang perlu Anda pahami dan ketahui di dalam kimia. Dimana, oksidasi ini tentunya tidak bisa dipisahkan dengan reduksi. Keduanya membentuk reaksi reduksi-oksidasi atau biasa disebut redoks. Reaksi redoks sendiri adalah suatu reaksi pelepasan dan pengikatan oksigen. Redoks adalah istilah yang digunakan.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10 Belajar Gratis di Rumah
Zn (s) + Cu2+(aq) → Zn2+(aq) + Cu (s) Reaksi keseluruhan adalah jumlah dari kedua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi yang disebut reaksi redoks. Reaksi di atas menunjukkan terjadinya pelepasan dan pengikatan elektron, maka dapat disimpulkan sebagai berikut. Oksidasi adalah peristiwa pelepasan elektron.

Banyaknya atom oksigen dalam Al2(SO4)3 adalah.
Sekali lagi, ini adalah nilai rata-rata karena struktur molekulnya adalah H 3 C−CH 2 −CH 3, dengan atom karbon pertama dan ketiga masing-masing memiliki bilangan oksidasi −3 dan atom pusat −2. Contoh dengan bilangan oksidasi pecahan yang benar untuk atom yang setara adalah kalium superoksida, KO 2.

Cara Menentukan Bilangan Oksidasi S dalam Ion S2O82 dan S4O62 yang Benar YouTube
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.