
Unsur X Dan Y Mempunyai Konfigurasi Elektron Sebagai Berikut Unsur Unsur
Jumlah proton = nomor atom = 16 Jumlah neutron = nomor massa - nomor atom = 32 -16 = 16 Jumlah elektron = nomor atom + elektron yang diikat = 16 + 2 = 18. Ion S2- memiliki 18 elektron, 16 proton, dan 16 neutron. Dari perhitungan di atas terlihat bahwa perubahan unsur menjadi ion, hanya mengubah jumlah elektronnya saja.
.jpg)
Semakin Besar Nilai Afinitas Elektron Suatu Atom Maka Atom Tersebut
Ketika suatu atom menerima elektron, maka penulisan muatan biloksnya diberi imbuhan tanda (-). Contoh: .. Suatu reaksi dinyatakan sebagai reaksi redoks apabila terjadi pengurangan atau pemotongan.. Elo cermati mana aja unsur yang mengalami perubahan biloks, hitung biloks setiap elemen, lalu hitung kenaikan atau penurunan biloks per.

Suatu unsur X mempunyai konfigurasi elektron [Ne] 3s^2 3p...
Sehingga jika atom netral menerima elektron, maka atom tersebut menjadi anion. Oleh karena itu jawaban yang tepat adalah B. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS!

Apabila unsur { )_(4) Be mencapai konfigurasi elektron
Nuklida Nuklida merupakan penulisan lambang suatu unsur secara umum, sebagai berikut.. Dengan keterangan sebagai berikut: X = lambang unsur Z = nomor atom A = nomor massa Nomor atom (Z) menunjukkan banyaknya jumlah proton (p) dalam suatu unsur.Pada atom netral, jumlah proton (p) sama dengan jumlah elektron (e).Nomor massa (A) ditentukan oleh jumlah proton (p) dan neutron (n) dalam inti atom.

Apa yang terjadi apabila benda A.dan B.memiliki elektron
Jadi, bilangan oksidasi unsur Na, Cl, dan O dalam NaClO3 adalah +1, +5, dan -2. Soal 2. Tentukan bilangan oksidasi unsur-unsur penyusun senyawa KMnO4! Jawab: Sesuai aturan nomor 2, bilangan oksidasi K adalah +1. O memiliki bilangan oksidasi -2. Maka, begini cara mengetahui bilangan oksidasi Mn. (1 x biloks K) + (1 x biloks Mn) + (4 x biloks O) = 0

Konfigurasi elektron suatu unsur adalah 1s^2 2s^2 2p^4. K...
Apakah Anda ingin belajar tentang notasi atom, yaitu cara menuliskan simbol, nomor atom, dan nomor massa suatu unsur? Jika ya, Anda dapat mengakses modul, rumus, dan soal notasi atom yang disediakan oleh Wardaya College, sebuah platform belajar kimia online. Anda juga dapat menguji pemahaman Anda dengan kuis interaktif yang menarik dan bermanfaat. Segera kunjungi Wardaya College dan pelajari.

Suatu unsur memiliki notasi 52 24Cr. Diagram orbital yang...
Manakala susunan elektron oktet ialah susunan elektron yang stabil yang mempunyai 8 elektron pada petala terakhir. Apabila sesuatu atom menderma atau menerima elektron, atom itu menjadi zarah bercas yang dikenali sebagai ion. Ion positif terbentuk apabila atom unsur logam menderma elektron. Ion negatif terbentuk apabila atom unsur bukan logam.

Konfigurasi elektron suatu unsur X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5. Unsur
A. elektron tidak dapat mengorbit di sembarang lintasan B. atom terdiri dari muatan positip yang tersebar merata dalam atom C. suatu unsur dapat bereaksi dengan unsur lain bila menerima energi D. muatan positip dan massa atom terpusatkan pada inti atom E. jika elektron berpindah lintasan, maka akan menyerap energi (Sumber soal : Soal EBTANAS 1992)

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Selamat datang di artikel kami tentang Apabila Suatu Unsur Menerima Elektron Maka. Dalam artikel ini, kami akan membahas secara rinci apa yang terjadi ketika suatu unsur menerima elektron. Kami akan menggali manfaat dan juga kekurangan dari fenomena ini, serta memberikan tabel yang berisi informasi lengkap tentang apa yang terjadi saat suatu.

CARA MENENTUKAN JUMLAH PROTON, ELEKTRON, NEUTRON UNSUR Na KIMIA KELAS X SMA YouTube
Atom-atom yang memiliki energi ionisasi rendah cenderung untuk melepaskan elektronnya. Atom-atom ini contohnya adalah atom dari unsur golongan IA dan IIA. Sedangkan atom-atom yang mempunyai arinitas elektron yang besar biasanya cenderung mengikat elektron. Atom-atom ini contohnya adalah unsur golongan VIA dan VIIA dalam sistem periodik unsur.

Contoh Soal Konfigurasi Elektron Ion
Jawaban: Apabila suatu unsur menerima elektron, maka bilangan oksidasinya akan turun. Zat tersebut mengalami reaksi reduksi, dan zat tersebut berperan sebagai oksidator. Pada reaksi tersebut dapat dilihat bahwa biloks Mg mengalami penurunan dari +2 menjadi 0. biloks Zn mengalami penurunan dari +2 menjadi 0. biloks K mengalami penurunan dari +1.
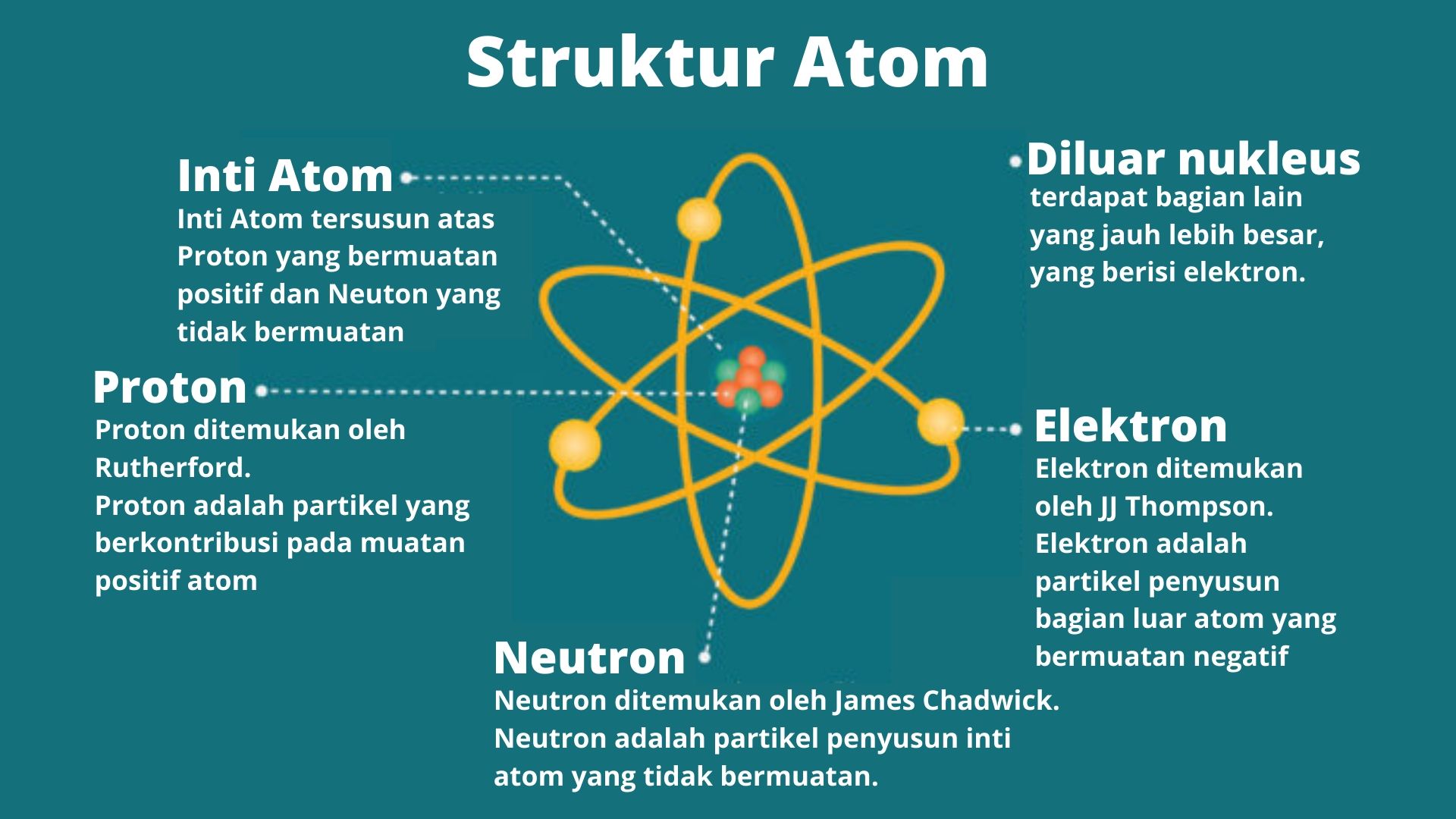
Penjelasan Struktur Atom Proton, Neutron, Elektron dengan Contoh Soal
Apabila suatu unsur menerima elektron, maka.. A. bilangan oksidasinya akan turun B. bilangan oksidasinya akan naik C. reaktivitasnya akan meningkat D. unsur tersebut mengalami oksidasi E. menghasilkan bilangan oksidasi positif. Konsep Reaksi Reduksi dan Oksidasi; Reaksi Reduksi dan Oksidasi serta Tata Nama Senyawa; Kimia Fisik dan Analisis

Menentukan Elektron Valensi Unsur YouTube
Maka biloks unsur Cl adalah +3 (b) Soal- Soal Latihan Bilangan Oksidasi (Biloks ) 1. Apabila suatu unsur menerima elektron,maka a. bilangan oksidasinya akan naik b. unsur tersebutmengalami oksidasi c. menghasilkan bilangan oksidasi positif d. reaktivitasnya akan meningkat e. bilangan oksidasinya akan turun 2. Bilangan oksidasi dari H₂S adalah 3.

Konfigurasi Elektron Dalam Orbital Untuk Unsur 18Ar Adalah Ujian
Oksidasi adalah reaksi dimana suatu zat direaksikan dengan sumber oksigen sehingga berikatan dengan oksigen tersebut (membentuk oksida).. Apabila unsur menerima elektron maka muatannya akan menjadi negatif sehingga bilangan oksidasinya kan menurun. 3.

Cara Menghitung Proton Elektron Dan Neutron Ujian
Sebelum membahas lebih jauh mengenai apabila suatu unsur melepas elektron, terlebih dahulu kita harus memahami pengertian unsur dan elektron.. Sebaliknya, apabila unsur tersebut menerima elektron pada kulit terluarnya, maka atom tersebut akan membentuk ion dengan muatan negatif. Ion negatif ini disebut anion. Contohnya seperti Cl- dan O2.

Konfigurasi elektron suatu unsur adalah 1s^2 2s^2 2p^6 3s...
Sifat Logam dan Non Logam. Ilustrasi logam (Dok PxHere.com) Sifat kelogaman suatu unsur tergantung pada besarnya energi ionisasi, dan afinitas elektron. Berdasarkan sifatnya, dalam sifat keperiodikan unsur, unsur atau atom dapat dibagi menjadi 3, yaitu unsur logam dan non logam serta metalloid. Lalu, apa saja sifat sifat dari unsur non logam.