
Bilangan Oksidasi Pengertian, Aturan dan Cara Menentukan
7 Aturan Bilangan Oksidasi dan Contoh Soal Lengkap. By Abdillah Posted on 31/01/2024. Aturan Bilangan Oksidasi - Langsung saja didalam Pengertian Bilangan Oksidasi didalam ilmu Kimia adalah suatu bilangan yg menunjukkan suatu ukuran kemampuan atas suatu Atom yang nantinya akan melepas dan menangkap suatu Elektron didalam pembentukkan suatu.

Cara Menentukan Bilangan Oksidasi Matob
Contoh Soal Bilangan Oksidasi (Biloks) Berikutn adalah beberapa contoh soal biloks beserta jawabannya yang dapat sobat gunakan sebagai latihan. 1. Tentukan bilangan oksidasi P dalam PH₃. Jawab: Biloks H = +1 (aturan biloks) Biloks PH₃ = 0. Biloks P + (3 × biloks H) = 0. Biloks P + (3 × (+1)) = 0.

BILANGAN OKSIDASI Ilmu Kimia
Aturan-aturan bilangan oksidasi adalah sebagai berikut: Bilangan oksidasi atom dalam bentuk unsur bebasnya sama dengan 0. Contohnya, bilangan. Pengertian bilangan oksidasi adalah jumlah muatan positif atau negatif yang dimiliki oleh suatu atom dalam bentuk ion maupun senyawa. Dalam menentukan bilangan oksidasi (biloks) kita juga harus mengikuti.

Cara Menentukan Bilangan Oksidasi Dunia Sosial
Bilangan kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal.. Bilangan Oksidasi Kimia (Biloks) - Aturan Penentuan Biloks, Tabel, Contoh Soal dan Jawaban; Pembakaran Kimia - Persamaan Kimia - Sempurna & Tak Sempurna dan Contoh Soal beserta.

Aturan Menentukan Bilangan Oksidasi atau Biloks Mudah Diingat Kimia X dan XII YouTube
Bilangan oksidasi adalah salah satu materi dalam pelajaran Kimia. Simak pengertian, aturan penulisan, dan contoh soalnya dalam pembahasan berikut ini.. (2016: 48), berikut aturan cara menentukan bilangan oksidasi atau biloks. Ilustrasi atom, molekul, maupun senyawa yang memiliki beberapa bilangan oksidasi. Foto: Pixabay. Aturan Menentukan.

Cara Menentukan Bilangan Oksidasi dan Contohnya
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

9 Aturan Bilangan Oksidasi Yang Perlu Anda Ketahui
Setelah mengetahui 9 aturan bilangan oksidasi, sekarang saatnya untuk memahami cara menentukan bilangan oksidasi melalui contoh soal di bawah ini yang dikutip dari buku Cara Mudah Belajar Kimia oleh Sutardi dan buku Kimia Dasar oleh Estiningsih Tri Handayani. Contoh Soal 1.

9 Aturan Bilangan Oksidasi Yang Perlu Anda Ketahui
7. Bilangan Oksidasi Hidrogen (H) adalah +1 Bila Berikatan dengan Non-Logam dan -1 Bila Berikatan dengan Logam. Contoh dari penerapan aturan ini seperti misalnya pada AlH 3 bilangan oksidasi H = -1. Pembuktian biloks H berdasarkan: Peraturan poin 3: Al memiliki bilangan oksidasi +3 karena termasuk unsur logam golongan IIIA

Jelaskan Pengertian Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi
- Bilangan oksidasi H dalam H 2 yaitu 0 - Bilangan oksidasi O dalam O 2 yaitu 0 - Bilangan oksidasi Cl dalam Cl 2 yaitu 0 - Bilangan oksidasi P dalam P 4 yaitu 0 - Bilangan oksidasi S dalam S 8 yaitu 0. 2. Bilangan oksidasi logam dalam senyawa selalu positif. Unsur logam golongan 1 (sistem lama gol. IA) (Li, Na, K, Rb, Cs, Fr.
9 Aturan Bilangan Oksidasi Yang Perlu Anda Ketahui
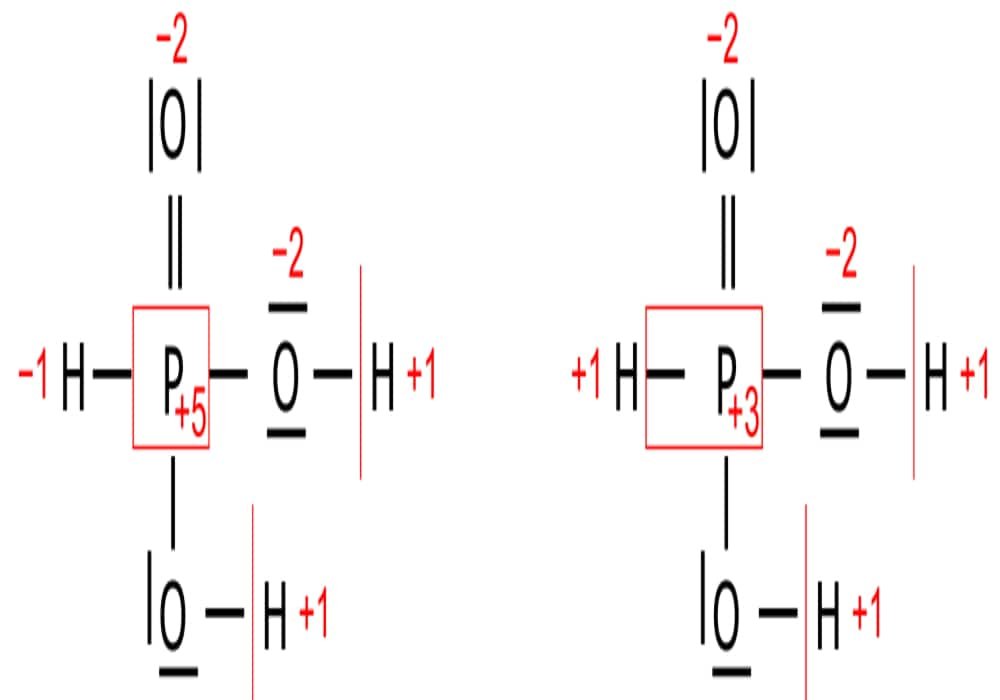
Bilangan Oksidasi Bilangan oksidasi ( biloks ) didefinisikan sebagai jumlah muatan negatif dan positif dalam atom, yang secara tidak langsung menandakan jumlah elektron yang telah diterima atau diserahkan. Atom yang menerima elektron akan bertanda negatif, atom yang melepaskan elektron bertanda positif. Dalam bahasa Inggris, bilangan oksidassi adalah oxidation state.

Aturan Penentuan Bilangan Oksidasi (Biloks) Chemistry Castel
Jumlah muatan positif dan negatif pada suatu atom inilah yang disebut dengan bilangan oksidasi atau biasa disingkat biloks/b.o. Aturan Bilangan Oksidasi Mengutip buku Aktif Belajar Kimia untuk SMA dan MA oleh Hermawan dkk (2009: 144), bilangan oksidasi sangat diperlukan dalam perhitungan reduksi dan oksidasi.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
sobat menurut aturan bilangan oksidasi di atas didapat biloks H = +1, nah untuk menentukan berapa biloks dari atom C menggunakan aturan sederhana berkut. Biloks H x jumlah atom H = +`1 x 4 = +4. Biloks C x jumlah atom C = a x 1 = a. Jika dilihat senyawa tersebut adalah senyawa netral yang berarti jumlah biloks unsur-unsur di dalamnya haruslah nol.

Aturan Menentukan Bilangan Oksidasi (Biloks) Unsur dan Senyawa Info Dari Ops
Sesuai aturan nomor 2, bilangan oksidasi Na adalah +1. Sementara itu, O memiliki bilangan oksidasi -2. Dari ketiga unsur penyusun senyawa NaClO3, hanya unsur Cl yang belum diketahui bilangan oksidasinya. Nah, untuk mengetahuinya, kamu bisa memanfaatkan unsur-unsur yang sudah diketahui bilangan oksidasinya.
Bilangan Oksidasi Kimia (Biloks) Tabel Biloks, Contoh Soal dan Jawaban
Aturan penentuan bilangan oksidasi. Bagaimana cara menentukan bilangan oksidasi? Bilangan oksidasi atom dan senyawa dapat ditentukan dengan aturan sebagai berikut: Baca juga: Soal UAS Kimia: Reaksi Redoks. Bilangan oksidasi atom dalam unsur bebas netral sama dengan nol. Contohnya, biloks Fe, Li, Na, O2, dan P4 sama dengan nol.

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Untuk menentukan bilangan oksidasi dengan benar, ada 9 aturan yang perlu Anda patuhi. Aturan-aturan tersebut yaitu: Unsur bebas memiliki biloks = 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas dibagi menjadi 2, yaitu unsur bebas berbentuk atom, misalnya C, Ca, Cu, Na, Fe, Al, Ne dan.

Aturan Penentuan Bilangan Oksidasi Materi Reaksi Redoks Kimia SMA Pojan.id YouTube
Aturan dalam Menentukan Bilangan Oksidasi. 1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya.